© Tagesspiegel
Physik: Eine Karte für den Mikrokosmos
Vor 100 Jahren entwarf Niels Bohr sein Atommodell. Es war ein entscheidender Schritt auf dem Weg zur modernen Physik.
Wer heute ein Smartphone benutzt, seinen Computer anschaltet oder seinen Einkauf an der Supermarktkasse abscannen lässt, denkt meist nicht daran, dass all diese Innovationen sich dem „Goldenen Zeitalter“ der Physik verdanken. In diesen entscheidenden Jahrzehnten zwischen Beginn und Mitte des 20. Jahrhunderts entwickelten kühne Forscher neue Theorien, die das bisherige Gedankengebäude der Naturwissenschaften umstürzten und durch neuartige Theorien ersetzten. Ein entscheidender Zwischenschritt auf diesem Weg jährt sich nun zum 100. Mal: das Bohr’sche Atommodell.
Der 1885 als Sohn eines Professors für Physiologie in Kopenhagen geborene Niels Bohr gehört zu den brillantesten Wissenschaftlern. Der breiteren Öffentlichkeit ist er aber nicht so gut bekannt wie einige seiner Schüler, zu denen Nobelpreisträger wie Heisenberg, Schrödinger und Pauli zählen. Das mag daran liegen, dass er sich gerne etwas umständlich auszudrücken pflegte. Das Denken in Alternativen entsprach aber durchweg seinem nachdenklichen Naturell. Seiner Arbeit als Wissenschaftler nutzte es sehr, Dinge aus mehreren Perspektiven zu betrachten. Vor allem auf dem unanschaulichen Terrain der Atomphysik.
Die Physik stand um die vorletzte Jahrhundertwende vor einigen schwer zu knackenden Rätseln. Eine Sorte Probleme betraf den Zusammenhang von Raum und Zeit. Diese konnte Albert Einstein mit seinem genialen Wurf, der Relativitätstheorie, lösen. Die andere Klasse von Problemen handelte von der Struktur der Materie, vom Aufbau der kleinsten Teilchen und ihrer Wechselwirkung mit Licht und anderen Formen von Strahlung.

© Wikipedia/AB Lagrelius & Westphal
Max Planck hatte gezeigt, dass Energie und Strahlung nur in kleinsten, diskreten Einheiten, den sogenannten Quanten, vorkommen. Diese Erkenntnis sprengte das Weltbild der damaligen Physik, wie sie sich nach der Mechanik Newtons und der Maxwell’schen Elektrizitätslehre darstellte. Nach der klassischen Physik sollten alle Übergänge kontinuierlich sein. Alles sollte sich in beliebig feine Einheiten unterteilen lassen, auch Energie und Strahlung. Mit einem Satz der alten Philosophen: Die Natur macht keine Sprünge.
Mit Plancks Entdeckung wurde den Physikern jedoch bewusst, dass die Natur durchaus Sprünge macht – ja sogar, dass das meiste in der Welt der Atome überhaupt nur in Sprüngen vor sich geht. Wenn es uns als kontinuierliches Geschehen erscheint, dann nur, weil wir so grobkörnig und verwaschen hinschauen, dass uns die vielen kleinen Sprünge nicht weiter auffallen. Mit neuen Instrumenten, insbesondere in der Spektroskopie, konnten die Physiker die Welt des Kleinsten aber immer besser erkunden.
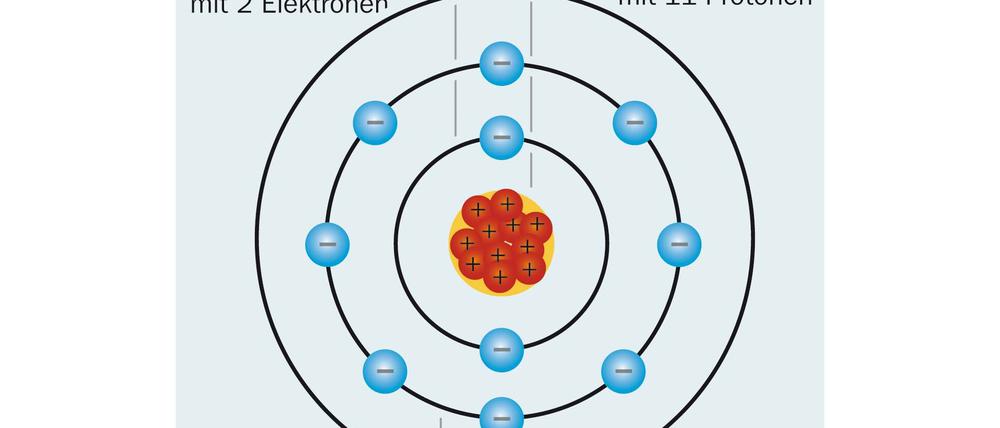
Dabei fanden sie immer mehr über die Atome als Bausteine der Materie heraus. Doch zugleich stellten sie fest, dass ihre Erkenntnisse sich nicht zu einem schlüssigen Bild zusammenfügten. Das Dilemma bestand darin: Nach dem, was man über elektrische Felder und Ladungen wusste, mussten beschleunigte geladene Körper Strahlung aussenden. Der englische Physiker Ernest Rutherford hatte herausgefunden, dass Atome aus einem winzigen Atomkern aus positiv geladenen Protonen bestehen, um den negativ geladene Elektronen kreisen.
Auf ihren Bahnen erfahren die Elektronen Beschleunigungen. Dies müsste sie dazu veranlassen, Strahlung auszusenden. Dabei verlören sie Energie und würden sich auf immer engeren Kreisen um den Atomkern bewegen, bis sie schließlich in ihn stürzen. Die Realität sieht aber anders aus, Atome sind grundsätzlich stabil.
Niels Bohr hatte bereits als junger Mann auf vielen Gebieten hervorragende Arbeit geleistet. Um seine wissenschaftliche Neugier und seinen Ehrgeiz zu befriedigen, suchte er nach einer wirklich großen Aufgabe. Als er das Stabilitätsproblem der Atome erkannt hatte, machte er sich verbissen an die Arbeit zu einem neuen Ansatz, den er schließlich in drei Teilen ab Juli 1913 im „Philosophical Journal“ publizierte.
Sein Vorschlag war so einfach wie genial. Er dachte sich das Atom als punktförmigen, positiv geladenen Kern, um den die Elektronen wie in einem Planetensystem kreisten. Um das Problem der Instabilität zu umgehen, führte er eine entscheidende neue Quantenregel ein. Demnach sollten nur die Kreisbahnen erlaubt sein, deren Energieniveaus ganzzahligen Vielfachen des Planck’schen Wirkungsquantums entsprechen. Der Raum dazwischen ist den Elektronen „verboten“. Zwischen den einzelnen Bahnen (oder Schalen) kann ein Elektron hin- und herspringen, wenn es Strahlung aufnimmt oder aussendet. Die Energie der Strahlung entspricht genau der Energiedifferenz zwischen diesen Bahnen.
Bohr war nicht der Erste, der sich mit Atommodellen und dem Stabilitätsproblem beschäftigt hatte. Er war aber derjenige, der dank seiner unglaublichen physikalischen Intuition – die sich mit derjenigen Einsteins messen konnte – und dank seiner Abstraktionskraft den Zusammenhang zwischen den Kreisbahnen, den Energieniveaus und den Planck’schen Strahlungsgesetzen sehen konnte.
Mit seinem Modell, das von anderen Forschern wie Arnold Sommerfeld weiterentwickelt wurde, brachte Bohr eine neue Art zu denken in die Atomphysik, die sich als fruchtbar herausstellen sollte. Das Bohr’sche Atommodell eignete sich nur für spezielle Atome wie Wasserstoff, die es gut beschreiben konnte. In schwierigeren Fällen erwies es sich als unzureichend. Die moderne Physik ging darum einen noch abstrakteren Weg. Mit der vollen mathematischen Theorie der Quantenmechanik durch Heisenberg und Schrödinger wurde Bohrs Modell dann obsolet. Elektronen wurden fortan keine festen Bahnen mehr zugeordnet, sondern lediglich Räume, in denen ein Aufenthalt wahrscheinlicher ist als an anderen Stellen. Bohr hatte als geistiger Vater die Entwicklung aber über Jahre begleitet. Sein Institut in Kopenhagen galt jungen Forschern als „Mekka der Atomphysik“.
Nachdem Dänemark von den Nazis besetzt worden war, floh der jüdischstämmige Bohr nach Schweden, wo er sich beim König erfolgreich um Asyl für seine jüdischen Landsleute einsetzte. Seine Flucht ging weiter in die USA. Nach der Rückkehr nahm er die Forschung wieder auf und gehörte zu den Mitbegründern des Kernforschungszentrums Cern in Genf. 1962 starb er schließlich in Kopenhagen.
Sein Name ist untrennbar mit der Quantenphysik verbunden. Nach Bohr sind ein Mondkrater, ein Element und mehrere handliche Größen in der Atomphysik benannt. Neben zahlreichen anderen Auszeichnungen bekam er 1922 auch den Nobelpreis für Physik. Die Einzelleistung, in der sein Name verewigt ist, bleibt aber sein – von der Entwicklung überholtes – Atommodell.
- showPaywall:
- false
- isSubscriber:
- false
- isPaid:
- showPaywallPiano:
- false