© FMP
Gesundheitsstandort Berlin-Buch: Blick fürs Ganze
In Buch wird auch das Gehirn erforscht – Nun haben Forscher eine molekulare Ursache von Hyperaktivität und epileptischen Anfällen entdeckt.
Grundlagenforscher haben es nicht leicht, den Zweck ihres Tuns der Öffentlichkeit zu vermitteln. So geht es auch Professor Volker Haucke, dem Direktor des Leibniz-Instituts für Molekulare Pharmakologie (FMP) am Campus Buch. Fragen nach dem praktischen Nutzen seiner Forschung beantwortet er gerne damit, dass es am FMP in erster Linie um das Verständnis der grundlegenden Prinzipien geht – um das große Ganze sozusagen. „Wir sind kein Pharmaunternehmen“, erklärt Haucke. „Unsere Mission ist es, gänzlich neue Ansätze aufzuspüren, die dann idealerweise von Biotechunternehmen weiter verfolgt werden können.“
Ob und wann zum Beispiel aus der jüngsten Entdeckung auf dem Gebiet der Gehirnforschung ein Target für Pharmaunternehmen wird, kann der FMP-Chef heute noch nicht sagen. Doch ein neuer Ansatz mit pharmakologischem Potenzial ist es allemal.
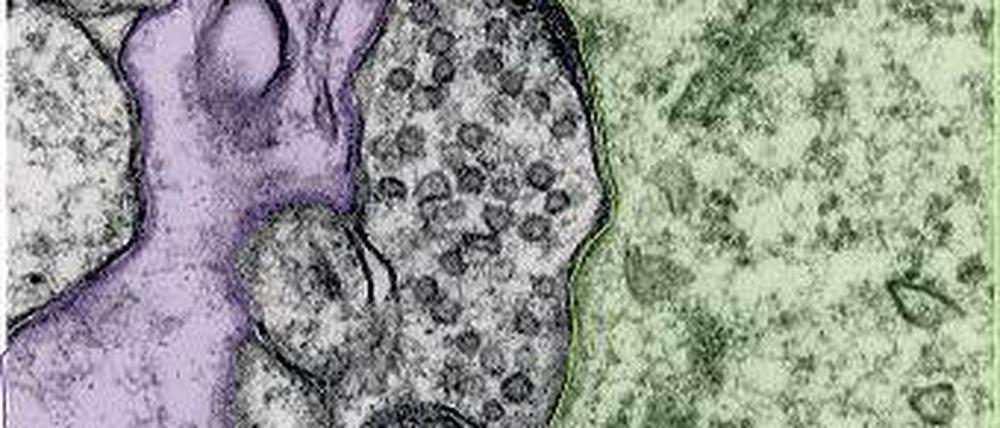
Hauckes Arbeitsgruppe beschäftigt sich mit jenen Vesikeln in den Synapsen, die durch den Medizinnobelpreis 2013 eine gewisse Berühmtheit erlangten. In den Bläschen sind chemische Botenstoffe, sogenannte Neurotransmitter, gelagert, die gebraucht werden, um elektrische Signale von einer Nervenzelle zur nächsten zu leiten. Da die Vesikel bei der Botenstoffausschüttung verbraucht werden, aber ständig neue benötigt werden, sorgen Dutzende Proteine dafür, dass alle Komponenten präzise recycelt werden.
Wie wichtig dabei ein bestimmter „Recycling-Helfer“ ist, konnte das Bucher Forscherteam jetzt erstmals zeigen. Schalteten sie das Protein AP180 in Mäusen aus, zeigten die Tiere eine Reihe von Auffälligkeiten. „Sie waren hyperaktiv, unvorsichtig, ja fast todesmutig und neigten zu epilepsieartigen Krampfanfällen“, berichtet Nachwuchsgruppenleiterin Tanja Maritzen. Zudem habe ihnen der natürliche Trieb zum Nestbau gefehlt.
Die Erklärung dafür fanden die Forscher in ihren Versuchen. Demnach bringt das Fehlen von AP180 die Balance zwischen erregenden und hemmenden Signalen gehörig durcheinander. „Unser Nervensystem hat immer einen Fuß auf der Bremse, damit es nicht zu einer Übererregung der Nervenverbindungen kommt“, erklärt Maritzen. „Doch die Bremsfunktion war in den AP180-losen Mäusen gestört, weil das Recycling der Vesikelkomponenten nicht richtig funktionierte.“
Mit dem Fund haben die Forscher mehr Licht in das grundlegende Geschehen der Erregungsübertragung gebracht und den Neurowissenschaften zugleich einen neuen Kandidaten geliefert: Die Ergebnisse legen nahe, dass bestimmte Mutationen im Gen für AP180 große Auswirkungen auf die Erregungsweiterleitung im Gehirn haben könnten und dadurch Hyperaktivität und Epilepsie auslösen. Erbkrankheiten, bei denen diese beiden Symptome kombiniert auftreten – zum Beispiel autistische Störungen –, könnten also auf Mutationen in diesem Kandidaten-Gen zurückzuführen sein.
Bislang ist das allerdings nur eine Vermutung. Gewissheit könnte draus werden, wenn man zunächst an genomischen Patientendaten und anschließend an humanen Stammzellmodellen gezielt nach AP180-Mutationen fahnden würde. Das sei zwar teuer und aufwendig, aber nicht unrealistisch, findet der Biochemiker und Zellforscher Volker Haucke. „Ich denke, dass es in zwei, drei oder vier Jahrzehnten möglich sein sollte, medikamentös direkt in die molekularen Krankheitsursachen einzugreifen“, sagt er. „Aber die Hoffnung, dass in fünf Jahren passende Arzneimittel in den Apotheken stehen, kann ich leider nicht erfüllen.“ bhg
Beatrice Hamberger
- showPaywall:
- false
- isSubscriber:
- false
- isPaid:
- showPaywallPiano:
- false