© Getty Images/iStockphoto
Immunonkologie: Wenn die Zellen erwachen
Onkologen sind inzwischen sehr erfolgreich darin, das Immunsystem für die Tumorabwehr zu aktivieren. Wie das funktioniert.
Die Idee an sich ist faszinierend: Krebs entsteht, wenn sich Zellen verändern, wenn sie aus einem bestimmten Grund mutieren – wenn sich der Körper quasi gegen sich selbst wendet. Warum also nicht das körpereigene Immunsystem, das ja in der Abwehr von Viren und Bakterien sehr erfolgreich sein kann, auch in den Kampf gegen Krebszellen miteinbeziehen? Doch bis vor zehn Jahren standen Onkologen vor einem Rätsel: Warum passiert es immer wieder, dass das körpereigene Immunsystem Krebszellen entweder (a) gar nicht erst entdeckt oder (b) sie zwar entdeckt, aber so blockiert wird, dass es sie nicht bekämpft?
Ein unverstandenes Phänomen, an dem alle Ansätze scheiterten, unser Immunsystem als vierte Säule den Behandlungsoptionen von Krebs hinzuzufügen – neben dem operativen Eingriff, der Chemo- und der Strahlentherapie. Dabei ist Tumorimmunologie kein neuer Gedanke. Ulrich Keilholz, internistischer Onkologe und Direktor des Charité Comprehensive Cancer Center in Berlin, hat sich dem Thema schon zu Beginn seiner klinischen Laufbahn vor 35 Jahren mit Leidenschaft gewidmet. „Damals gab es sehr wenige wissenschaftliche Erkenntnisse dazu“, erzählt er. „Unvorstellbar, wenn man es mit dem vergleicht, wo wir heute stehen.“
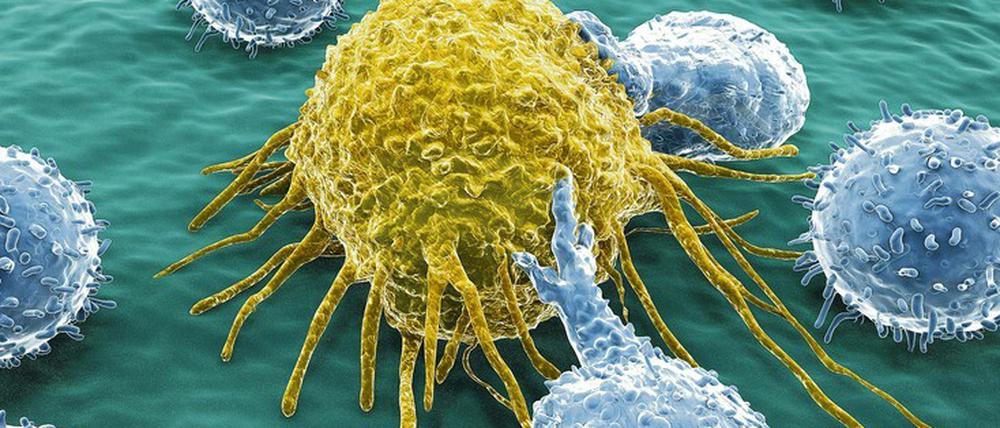
Dass unser Immunsystem auch entartete Krebszellen beobachtet und erkennt, wusste man schon lange. Unmittelbar nachweisen konnte und kann man diesen Vorgang allerdings nicht, nur durch sogenannte indirekte Evidenzen. Das Immunsystem kann vor allem diejenigen Zellen aufspüren, die sehr mutationsfreudig sind, die sich also durch viele Mutationen der DNA stark verändert haben. Dazu gehören zum Beispiel Haut-, Lungen-, Kopf-Hals-, Blasen- oder Magentumore. Zumindest bei den ersten beiden, bei Haut- und Lungenkrebs, ist auch sofort einsichtig, warum sie so häufig mutieren: Hier wirken äußere Einflüsse in Form von Sonnenlicht oder Zigarettenrauch kontinuierlich auf die gesunden Zellen ein und führen zu immer neuen Veränderungen.
Erkennen ist das eine. Doch wenn daraus keine Aktion folgt, hilft es nichts
Relativ unauffällig hingegen verhalten sich kindliche Tumore (Bindegewebs- und Blutkrebs- oder Hirntumore) sowie Bauchspeicheldrüsen-, Eierstock- und Brustkrebs. Sie mutieren nur wenig, deshalb kann das Immunsystem sie nur schlecht oder gar nicht erkennen. Und dann gibt es noch Darmkrebs: „Auch ihn erkennt das Immunsystem nicht, obwohl es hier eigentlich zu vielen Mutationen kommt“, sagt Ulrich Keilholz. Eine der vielen derzeit ungelösten Fragen der Onkologie. Schafft es auch nur eine einzige Zelle auf diese Weise, das Immunsystem zu überlisten, kann sie zum Ausgangspunkt für eine Krebserkrankung werden.
Erkennen ist das eine. Doch wenn daraus keine Aktion folgt, hilft es nichts. Jahrzehntelang wussten Mediziner keine Antwort darauf, warum das Immunsystem manche Zellen durchaus erkennt, dann jedoch in seiner Wirkweise blockiert wird. Viele Arbeitsgruppen, auch an der Charité, haben immer wieder zeigen können, dass bei Krebspatienten bestimmte T-Zellen – die dafür zuständig sind, Eindringlinge zu bekämpfen – Tumorzellen zwar prinzipiell erkennen können, aber funktionell gebremst sind. Der Durchbruch ereignete sich vor rund zehn Jahren, und zwar gleichzeitig in den USA, Europa und Japan. „Seither kennen wir eine entscheidende Antwort“, erklärt Ulrich Keilholz. Sie lautet: Tumorzellen können das Immunsystem täuschen und dazu bringen, seine Aktivität einzustellen, obwohl es das nicht soll. Knackpunkt dabei war die Entdeckung der so genannten Immuncheckpoints.
Untersucht man Tumorgewebe ganz genau, zeigen sich häufig klare Merkmale, die belegen, dass sich die Tumorzellen einem vorherigen Angriff des Immunsystems entzogen haben. Sie können etwa immunsupprimierende Zytokine (Gewebshormone) produzieren, die jegliche Immunantwort fernhalten. Oder aber sie bilden auf ihrer Oberfläche Immuncheckpoints aus. Das sind Moleküle, die die Aktivität der T-Zellen regulieren. Denn die T-Zellen müssen wissen, wann es genug ist, sonst kommt es zu einer überschießenden Reaktion, das Immunsystem hört nicht auf mit seiner Aktivität und richtet sich auch gegen gesunde Zellen. Die Checkpoint-Rezeptoren hegen das Immunsystem ein, halten es im Zaum, kontrollieren und moderieren es. „Immuncheckpoints sind überlebenswichtig für uns“, sagt Ulrich Keilholz. Für die Entdeckung der ersten beiden dieser Immuncheckpoints wurden der Amerikaner James Allison und der Japaner Tasuku 2018 mit dem Nobelpreis für Medizin ausgezeichnet. Denn ihre Entdeckung war der Schlüssel für die Entwicklung der heutigen Immuntherapie.
Mit Antikörpern die Bremse lösen
Wie sieht die nun genau aus? Indem sie eigene Immuncheckpoints ausbilden, schaffen es Krebszellen, das Immunsystem zu überlisten – es stellt seine Aktivität ein. An dieser Stelle kommt eine andere Substanzklasse ins Spiel, die Checkpoint- Inhibitoren, also „Hemmer“. Das sind künstlich hergestellte Eiweißmoleküle, die der Patientin oder dem Patienten verabreicht werden. Sie sorgen dafür, dass das Immunsystem wieder in Gang kommt und die Krebszellen attackieren kann. „Mit diesen Antikörpern lösen wir sozusagen die Bremse“, erklärt Ulrich Keilholz. „Die Inhibitoren sind aktuell der Blockbuster in der Pharmaindustrie und ermöglichen uns bei vielen Krebspatienten eine langfristige Tumorkontrolle.“ Die Idee, Checkpoint-Inhibitoren als Blockadelöser einzusetzen, sind die eigentliche Revolution in der Tumorimmunologie.
Rund 10 000 Krebspatienten in Deutschland werden aktuell mit der Immuntherapie behandelt, allerdings vor allem in der Palliativtherapie. Ziel ist, Leiden zu lindern, das Leben von Patientinnen und Patienten mit metastasierter Tumorerkrankung deutlich zu verlängern und erträglicher zu machen. Vor allem bei Melanomen, also schwarzem Hautkrebs, und bei Lungenkrebs wird die Immuntherapie eingesetzt. Patient oder Patientin leben zu Hause und kommen nur alle 14 Tage für eine einstündige Infusion in die Klinik. Erstmals angewendet wurde das Verfahren in Deutschland im Jahr 2004 – an der Charité. Damals traten noch häufig Nebenwirkungen auf, vor allem Lungen- oder Darmentzündungen mit nachfolgendem Durchfall. Da die Antikörper inzwischen gewechselt wurden und in der Anwendung sehr viel Erfahrung besteht, sind diese Nebenwirkungen sehr selten geworden.
Die Kosten für die Immuntherapie sind allerdings erheblich, sie liegen jährlich bei rund 80 000 Euro – wenn die Therapie sehr erfolgreich ist und daher über lange Zeit gegeben wird, bei Melanomen zum Beispiel in 80 Prozent der Fälle für mindestens ein Jahr. „Entsprechend der Regulationsmechanismen im Gesundheitssystem fängt der Preis insgesamt langsam an zu sinken, weil sich die Einsatzgebiete ausdehnen“, erklärt Ulrich Keilholz. Und im Vergleich zu einer Variante der Immuntherapie, der so genannten CAR-T-Therapie, wirken die 80 000 Euro noch günstig: Diese kostet fast 400 000 Euro im Jahr. Dabei wird die Oberfläche der T-Zellen im Labor gentechnisch so verändert, dass die Zellen künstlich auf die Krebszellen abgerichtet werden. Aktuell leben in Deutschland nur rund hundert Patienten, die auf diese Weise therapiert werden.
Keine Wunderwaffe, aber eine wichtige Therapieoption
Gentechnik ist hierzulande immer ein Reizthema, Ulrich Keilholz kritisiert dabei eine gewisse Widersprüchlichkeit, ja Heuchelei: „Die Herstellung der Wirkstoffe unterliegt in Deutschland hohen Genehmigungshürden, ihre Anwendung ist aber eher erwünscht.“ Dabei sei die Gefahr, dass das Erbgut des Menschen verändert wird, etwa in Fall der CAR-T-Therapie überhaupt nicht gegeben: Die gentechnisch veränderten Zellen reproduzieren sich nicht, sie sterben außerhalb des Patienten einfach ab. Ob diese Therapie dauerhaft für einen größeren Patientenkreis in Frage komme, sei noch unklar, so Keilholz.
Wie immer in der Medizin ist die Immuntherapie heute keine allwirkende Wunderwaffe, sondern eine wichtige weitere Therapieoption, die die Möglichkeiten im Kampf gegen Krebs erheblich erweitert. Anders als die Chemotherapie ist sie auch wesentlich schonender, denn Chemotherapie tötet grundsätzlich alle auffälligen, und das heißt schnell wachsenden Zellen ab, egal ob gesund oder krank, mit den bekannten Nebenwirkungen. Wäre es also am besten, beide Therapien parallel einzusetzen? „Früher galt das Dogma, Immun- und Chemotherapie niemals gleichzeitig anzuwenden“, sagt Ulrich Keilholz. Auf dem 34. Deutschen Krebskongress in Berlin hat er gerade erst einen Vortrag zur Kombination der beiden Therapien bei Kopf-Hals-Karzinomen gehalten. „Inzwischen wissen wir, dass von den rund 50 bekannten Chemotherapien mindestens fünf sehr gut mit der Immuntherapie funktionieren, und weitere werden getestet.“ Das Verhältnis kann man nicht als statischen Gegensatz beschreiben, es ist dynamisch.
Sechs Checkpoint-Inhibitoren sind derzeit in der Palliativtherapie zugelassen. Ziel der Onkologen ist aber, die Inhibitoren auch in der Primärtherapie anzuwenden, wo tatsächlich vollständige Heilung vom Tumor angestrebt wird. Zwei Substanzen sind bereits ebenfalls für die Primärtherapie von Lungenkrebs und Melanomen zugelassen. Und da eine große Zahl von Studien bei vielen anderen Krebserkrankungen läuft und zudem neue Inhibitoren in der Entwicklung sind, wird das System ständig weiterentwickelt und neu austariert. Nicht die schlechtesten Aussichten für die Zukunft.
- showPaywall:
- false
- isSubscriber:
- false
- isPaid:
- showPaywallPiano:
- false